Продолжение
Моечная оборудуется:
--------
нагревательными приборами для подогрева воды;
раковинами;
досками для сушки посуды;
сушильными шкафами;
баками с деэростворами;
шкафами для посуды и хранения моечных средств.
Препараторская служит для хранения запасов имущества (посуды, кра-
---------------
сок, химикалиев, питательных сред, аппаратов, приборов и пр.). В ней
устанавливают шкафы, столы, холодильник. Здесь готовят растворы кра-
сок, содой, дезинфицирующих средств; ватные пробки.
2.2. Оборудование, аппаратура, материалы
и реактивы для лпборатории
Микробиологический отдел производственной лаборатории должен быть
оснащен всем необходимым для проведения бактериологических анализов.
Количество единиц оборудования, аппаратуры и реактивов зависит от
асортимента выпускаемой продукции и количества ежедневных анализов.
Примерный перечень аппаратуры, материалов, реактивов для оснаще-
ния микробиологической лаборатории представлен ниже.
Оборудование и аппаратура,инструменты
------------------------------------
Автоклав для стерилизации чисток посуды и питательных средств
Автоклав для убивки отработанного материала и бактериальных куль-
тур
аппарат для встрянивания ( шуттель)
Анаэростат
Баня водная с терморегулятором, обеспечивающим температуру до 100
гр.С с точностью -0,5гр.С
Весы лабораторные
гомогенизатор по ГОСТ 9111-59
Горелки газовые и спиртовые по ГОСТ 10090-74
Дистилятор электрический Д-4
Лампы бактерицидные ДБ- 0 или ДБ -60 (1,5-2,5 вт на 1 куб.м воз-
духа)
Лупа с увеличением 8-10 по ГОСТ 8309-75
Микроскоп биологический МБИ, МБВ или другой парки по ГОСТ 8284-67
Мясорубка по ГОСТ 4025-73
Ножи из нержавеющей стали
Нож консервный
Ножницы из нержавеющей стали
Палочки стеклянные по Гост 9425-71
Петля бактериологическая
Пинцеты разные
Плита газовая или электрическая, битовая
Прибор Зейца с воронками (фильтр Зельца) и прибор для подсчета
Пробосборники, ляжки, долота из нержавеющей стали
Скальпели разные
Сушильный шкаф
Ступка фарфоровая вместимостью 300-500 куб.см с пестиками по ГОСТ
10444.1-84
Термостаты с диапазонсы температур 24-70 гр.С
Термометры от 0-5 гр.С до 50-100 гр.С, 100-150 гр.С по ГОСТ
2823-73
Треножник металлический
Холодильники бытовые
Часы песочные на 1.2.3.5 мин. ро ГОСТ 10576-74
Шпатели стеклянные
Штативы для пробирок разной вместимости
Электроплитки по ГОст 306-69
Материалы:
---------
Бумага оберточная
Бумага пергамент, полупергамент
Бумага фильтрованая по ГОСТ 12026-76
Вата медицинская гигроскопическая по ГОСТ 5556-75
Карандаши по стеклу
Марля медицинская по ГОСТ 9412-77
Мыло
Порошки стиральные
Сетка асбестовая
Фильтр асбестовый
Шпагат
Щетка, ерши для мойки посуды
Реактивы, краски, среды, препараты:
--------
Агар микробиологический по ГОСТ 17206-71
Агар сухой питательный, выпускаемый Минмедпромом, готовят по про-
писи на этикетке
Агар висмут-сульфитный
Альфа-нафтол (ГОСТ 5838-79)
Бромкразолпурпур (ТУ 6-09-1386-76)
Бромтимоловый синий (ТУ 6-09-2045-72)
Вазелин медицинский (ГОСТ 3882-52)
Вода дистилированная (ГОСТ 6709-72)
Генциан фиолетовый
Глицирин х.ч. (ГОСТ 6824-76)
Глюкоза х.ч. ч.д.а. (ГОСТ 6038-79)
Дезокомрибонукленновая кислота (ДНК) высокополиниризованная
(ТУ 6-09-4230-78)
Дрожжи хлебопекарные прессованные (ГОСТ 171-69)
Дрожжевой автолизат
Дрожжевой экстрат
Железо сернокислое (ГОСТ 4148-78)
Желчь крупного рогатого скота или медицинская
(биллирубин, ТУ 6-09-10-364-75)
Зелень бриллиантовая (ТУ 6-09-42-78-76)
Йод кристаллический ( ГОСТ 4159-79)
Калий гидрат окиси (едкий) технический (ГОСТ 9285-76)
Калий йодистый (ГОСТ 4275-74)
Калий фосфорнокислый двузамещенный (ГОСТ 2493-75)
Калий фосфорнокислый однозамещенный (ГОСТ 4198-75)
Калий углекислый (мел. ГОСТ 83-79)
Кальций фосфорнокислый двузамещенный (ГОСТ 3204-76)
Кальций хлористый (ГОСТ 4460-77)
Картофель свежий продовольственный (ГОСТ 7176-68)
Кислота лимонная (ГОСТ 908-79Е)
Кислота соляная (ГОСТ 3118-67)
Кислота фосфорная (ГОСТ 10678-71)
Кислота уксусная (ГОСТ 61-75)
Крахмал растворимый (ГОСТ 10163-76)
Кристаллический фиолетовый (ТУ 6-09-4119-75)
Лактоза (ТУ 6-09-229-72)
Лакмус (ТУ 6-09-4313-76)
Магний хлористый
Мальтоза (ТУ 6-09-3476-73)
Масло вазелиновое (ГОСТ 3164-78)
Масло иммерсионное (ТУ 81-05-79-69)
Метиловый красный (ГОСТ 5853-51)
Молоко свежее пастеризованное (ГОСТ 13277-79)
Мочевина (ГОСТ 6691-77)
Натрий гидрат окиси (едкий, ГОСТ 11078-78)
Натрий селенистокислый
Натрий сернокислый (ГОСТ 429-76)
Натрий фосфорнокислый двузамещенный12Н О (ГОСТ 4172-)
2
Натрий фосфорнокислый однозамещенный (ГОСТ 246-76)
Натрий фосфорнокислый двузамещенный безводный
(ГОСТ 11773-76)
Натрий хлористый (ГОСТ 4233-77)
Парвфин (ГОСТ 23683-79)
Пептон бактериологический (ГОСТ 13805-76)
Перекись водорода (ГОСТ 10929-76)
Печень говяжья, свинина
Плазма сухая или свежеприготовленная крольчья или человека,
приготовленная по ГОСТ 10444.2-75
Сахароза ч.д.а. (ГОСТ 5833-75)
Спирт этиловый 70 и 96%-ный (ГОСТ 18300-72 и ГОСТ 5962-67)
Среды сухии питательные, выпускаемые Минпещепром или
Минмедпром, готовят по прописи на этикетке:
с маннитом и индикатором ВР;
с глюкозой и индикатором ВР;
среда Кода;
среда Левина;
среда Плоскирева;
среда Эндо;
Трифенилтетразолий хлорид 2, 3, 5 (ТУ 6-09-3838-78)
Яйца куриные свежие
Растворы буферные для проверки рН-метра
Дезинфицирующие вещества:
-----------------
Хлорная известь
Хлорамин
Поргядродь
Фенол, едкий натр
и другие хлорсодержание вещества, разрешенные Минздравом СССР.
2.3. Лабораторная посуда, ее подготовка и хранение
В микробиологическом отделе производственной лаборатории
должна быть следующая посуда:
Ведра эмалированные с крышками
Воронки стеклянные по ГОСТ 8613-64
Кастрюли эмалированные разной вместимостью (0,5 л, 1 л, 2 л, 3л)
по ГОСТ 17151-71
Колбы стеклянные широкогорлые плоскодонные на 50, 100, 150, 200,
300, 500, 1000, 2000, 3000, куб.см по ГОСТ 10972-72
Лотки эмалированные
Пипетки пастеровские
Пипетки бактериологические вместимостью 1, 3, 5, 10, 20 куб.см с
ценой деления 0,01 куб.см на полное опорожнение по Гост 1770-74
Поплавки стеклянные (маленькие пробирки, приципитационные)
Пробирки бактериологические по ГОСТ 10515-75)
Стеклянные банки с крыжками 0,5-1,5 л
Стекла покровные по ГОСТ 6672-75
Стекла предметные по ГОСТ 9274-75
Стекла часовые одиночные 600-800
Стаканчики для взвешивания, (бокса) разной вместимости
Цилиндры стеклянные мерные вместимостью 50, 100, 500 куб.см
Чашки Петри бактериологические по ГОСТ 10973-75
Лаборатория посуда для микробиологических исследований
подвергается мойке, сушке, упаковке в бумагу или специальные
металические закрывающиеся футляры и стерилизации.
При подготовке новой посуды ее погружают в ведро с теплой
водой, в которой растворяют хозяйственное мыло и ставят на слабый
огонь. После 15-минутного кипячения посуду вынимают, ополаскивают чис-
той водой. Затем кипятят в течение 15 мин в подкисленной воде
(1-2%-ные растворы соляной кислоты), ополаскивают водопроводной и дис-
циллированной водой.
Посуду, бывшую в употреблении, моют 0,5%-ным щелочным раствором с
помощью ершей и щеток и ополаскивают водопроводной водой.
Посуда, в которой содержался зараженный материал, поступает в
мойку после предварительной дезинфекции (убытки в автоклаве),гаранти-
рующей гибель находящихся в ней патогонных микроорганизмов.
Сильную загрязненную посуду со следами жира, красок и имерсион-
ного масла опускают на 2 часа в хромовую смесь, подогретую до 45
гр.С., затемтщательно промывают прочной водопроводной водой.
Посуду с питательными средами после подсчета на них споровых мик-
роорганизмов обеззараживают перед мойкой путем стерилизации в автокла-
ве при 121 гр.С в течение 1,5 ч.
Вымытую посуду не вытирают, а сушат при комнатной температуре
(холодная сушка) или горячим воздухом в сушильном шкафу при температу-
ре 100-105 гр.С.
Предметные стекла после мойки и ополаскивания вытирают чистой
салфеткой или помещают в склянку с притертой пробкой в смесь срирта и
этилового эфира в соотношении 1:1.
Лабораторную посуду перед использованием стерилизуют. Стерилизуют
сухим жаром в сушильном шкафу при температуре 150, 160 и 180 гр. С.
соответственно 2 ч, 1 ч и 30 мин; или вавтоклаве при давлении 1м эти
(121 гр.С) в течение 30 мин - 1 ч.
Пробирки, флаконы, бутыли, матрацы и колбы закрывают ватномарле-
выми пробками. Поверх пробок на каждый сосуд (кроме пробирок) надевают
бумажные колпачки.
чашки Петри стерилизуют завернутыми в бумагу по 1-5 шт. Пасте-
ровские пипетки по 3-15 шт заворачивают в плотную оберточную бумагу. В
верхнюю часть каждой пипетки вкладывают кусочек ваты.
Изготовленные ватные или марлевые тампоны стерилизуют каждый в
отдельности или несколько штук заворачивают в плотную бумагу.
Стерилизуют в автоклаве при температуре 121 гр.С. в течение 30
мин.
Тампон может быть закреплен на конце металлической проволоки или
деревянной палочки, пропущенной через ватную пробку. В этом случае его
вместе с пробкой вставляют в пробку с 3-4 или 10 куб.см. физиологичес-
кого раствора.
Стерильную посуду хранят в плотно закрывающихся шкафах или ящиках
с крышками.
Срок хранения стерильной посуды не более 30 суток.
3. МЕТОДЫ МИКРОБИОЛОГИЧЕСКОГО КОНТРОЛЯ
3.1. Определение общего количества мезофильных
аэробных и факультативно-анаэробных микро-
организмов - общее микробное число (ОМЧ)
Метод основан на количественном подсчета колоний микроорганизмов,
вырастающих на плотном питательном агаре при температуре 30 гр.С в те-
чение 72 ч.
При исследовании образцов на ОМЧ руководствуются ГОСТ 26670-86.
ГОСТ 9958-81 с учетом нижеизложенных рекомендаций.
Для определения ОМЧ следует выбирать разведения, при посеве кото-
рых на чашках Петри вырастает не менее 30 и не более 300-колоний. При
посеве продуктов, не требующих разведения, учитывают все выросшие на
чашках колонии (т.е. и менее 30).
При посеве по 1 куб.см. цельного продукта или каждого соответс-
твующего его разведения вносят в 2 чашки Петри (параллельное определе-
ние) и заливают в каждую чашку по 15-20 куб.см. агаризованной пита-
тельной среды, расплавленной на водной бане и остуженной до 45 гр.С.
Сразу после заливки агара содержимое чашки Петри тщательно пере-
мешивают путем легкого вращательного покачивания для равномерного
распределения посевного материала.
После застывания агара чашки с посевами помещают в термостат дном
вверх, инкубируют при 30 гр.С. в течение 72 ч; при необходимости пред-
варительный учет производят через 48 ч.
Количество колоний подсчитывают на каждой не засеянных чашек.
Счет колоний на чашках производят с помощью прибора для счета
колоний бактерий или лупы. Для лучшей видимости считают колонии на тем-
ном фоне(под чашку кладут темнуу бумагу), чашки помещают дном кверху.
Каждую колонию отмечают на две чашки чернилами или тушью.
При подсчете придерживаютя следующих правил:
- если на чашке выросло небольшое количество колоний, примерно до 100,
подсчитывают все колонии;
- если колонии распределены равномерно и их количество измеряется нес-
колькими сотнями (200-300 колоний), допускается под отчет колоний не
менее чем на 1/3 площади чашки. В этих случаях дно чашки делят каран-
дашом на 6 секторов и считают колонии в 3 секторах. Затем делают пе-
ресчет на всю площадь чашки: вычисляют среднее количество колоний на
площади одного сектора и полученное количество колоний на одном секто-
ре умножают на 6.
Число колоний, выросших на чашке, должно отражать количество жиз-
неспособных микроорганихмов, содержащихся в засеянном объеме исследу-
емого материала. Поскольку последний , как правило, засевают в разве-
денном виде, число выросших на чашке колоний умножают на степень взято-
го разведения, рассчитавают среднее арифметическое и устанавливают ко-
личество мезофильных аэробных и факультативно-анаэробных микрооргани-
змов в 1куб.см. продукта.
При установлении количества мезофильных бактерий на все чашки мо-
гут быть использованны для вычисления среднего арифметического:
- нельзя использовать посевы для вычисления среднего арифметического,
если количество выросших колоний на чашках менее 30. В этом случае в
протокол исследований вносят показатели обсемененности, полученые при
подсчете колоний только по одной или двум чашкам, число колоний на ко-
торых более 30. В случае роста колоний на засеянных чашках в количест-
ве менее 30, в результатах анализа рекомендуется следующая формулиров-
ка: "Рост единичных колоний при посеве (указать количество засеянного
продукта);
- не используются посевы для вычисления среднего арифметического пока-
зателя на тех чашках, на поверхности которых более чем на 1/2 площади
отмечается ползучий рост спорообразующих микроорганизмов; последние
могут маскировать рост прочих бактерий. Возможны случаи когда на чаш-
ках из всех разведений получают рост споровых микроорганизмов, и подс-
чет изолированных колоний практически невозможен. В этих случаях в
протоколе исследования следует указать:"Рост спорообразующих микроор-
ганизмов".
Пример расчета: если на чашках Петри при посеве 0,1 г продукта
выросло в среднем 135 колоний, а при посеве 2-го разведения (0,01 г
продукта) - 9 колоний, то в результатах исследования учитывают цифро-
вые данные, полученные при посеве 1-го разведения, т.е. количество
микроорганизмов 135х10 - 1350 в 1 г продукта.
Для получения более точных данных по количеству мезофильных бак-
терий, целесообразно сопоставлять результаты подсчета колоний, полу-
ченные на чашках с посевами материалы из последовательных разведений.
Числа подсчитаных колоний должны примерно соответствовать кратности
взятых разведений.
Если количество колоний на чашках с посевами из последующих раз-
ведений (1:10, 1:100) почти совпадает или моло между собой разнится,
то это указывает на недостаточное перемешивание посевного материала
при приготовлении разведений и перед посевом.
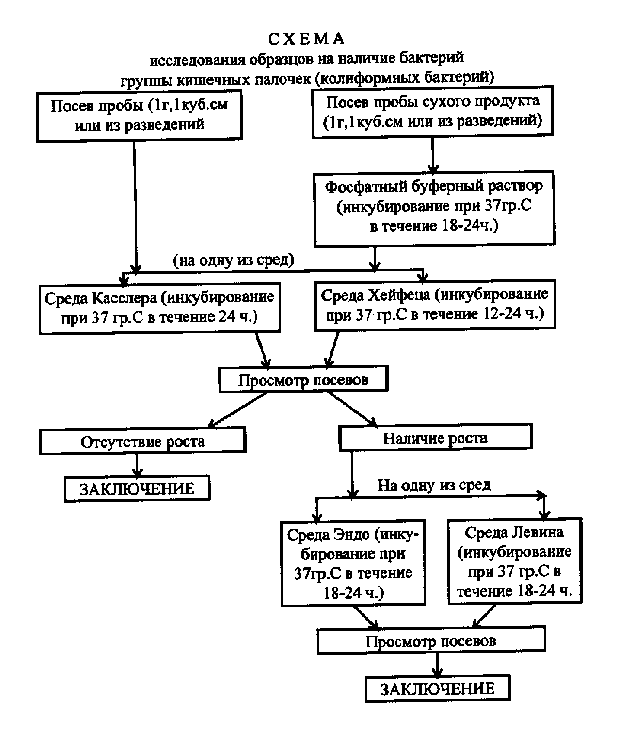
3.2. Определение бактерий группы кишечных палочек
В соответствии с принятой международной номенклатурой в настоящей
Инструкции к бактериям группы кишечных палочек (БГКП) отнесены грамот-
рицательные, не образующие спор палочки, сбраживающие лактозу с обра-
зованием кислоты и газа при температуре 37 гр.С. в течение 24-48 ч, в
основном являющиеся представителями родов Esherichia,Citrobacter,Klebsi-
ella,Screatier (т.е. учитываются как цитратотрицательные, так и цитрат-
положительные варианты БГКП).
Методы исследования на БГКП приведены в ГОСТ 7702.2-74; ГОСТ
9988-81, при этом следует учитывать следующие методические рекоменда-
ции.
Для посева используют то количество продукта (1 г и т.д.), в ко-
тором предусматривается отсутствие БГКП (колиформных бактерий). После
производят в среду Касслер с лактозой (с поплавками), либо в среду
Хейфеца с лактозой (с поплавками) с соблюдением соотношения продукта и
среды 1:10. Применение среды Кода не допускается.
Посевы инкубируют при температуре 37 гр.С в течение 24 ч. При от-
сутствии признаков роста - газообразования и изменения среды, дают
заключение об отсутствии БГКП (колиформных бактерий) и в соответствии
исследуемого продукта нормативу на БГКП.
При наличии признаков роста на среде Косслер или Хейфеца для
окончательного заключения о наличии в продукте БГКП из подозрительных
пробирок производят посев на чашки со средой Эндо или Левина. Посев
производят петлей из каждой пробирки так, чтобы получать рост изолиро-
ванных колоний. Чашки с посевами инкубируют при температуре 37 гр.С в
течение 18-24 ч.
При отсутствии на среде Эндо и Левина колоний, типичных для БГКП
(на среде Эндо - красных с металлическим блеском или без него, розовых
и бледнорозовых, на среде Левина - черных с металлическим блеском,
темных с черным центром, сереневых с темным центром) - засеянная на-
веска продукта считается незагрязненной ими, т.е. исследующий продукт
соответствует нормативу на бактерии группы кишечных палочек.
При наличии на среде Эндо или Левина типичных для кишечных пало-
чек (колиформных бактерий) колоний - их продолжают изучать. Из изоли-
рованных колоний, каракторных или подозрительных на БГКП, делают пре-
параты, окрашивая их по Граму и микроскопируют. Обнаружение типичные
для кишечных палочек грамотрицательных не содержащих спор палочек ука-
зывает на наличие бактерий группы кишечных палочек в анализируемой
массе продукта и несоответствие продукта микробиологическому нормативу.
Схема 1.

3.3.
Определение бактерий из рода сальмонелл
Сальмонеллы - обширный род семейства этеробактерий, заключающих
более 2200 серотапов, большинство из которых обладает потогонными
свойствами, К сальмонеллам относятся аэробные и факультативно-анаэроб-
ные грамотрицательные подвижные,(за исключением S.gallinarum-pallorum)
палочки, хорошо растущие наобычных питательных средах и разнообразных
пищевых субстратах.
При исследовании образцов на наличии сальмонелл руководствуется
ГОСТ 7702.2-74; ГОСТ 9958-81, ГОСТ 25311-82 с учетом нижеизложенных ме-
тодических рекомендаций.
Навеску продукта (25 г или др.) высевают в поптонную буфорную во-
ду в соответствии 1:9. Посевы инкубируют при 37 гр.С в течение 18-24 ч.
После этого производят пересев по 1 куб.см. культуры из поптонной
буферной воды в одну из сред: Мюллера, Кауфмана, хлормагнитаемую М,
селенитовый бульон в соответствии посевного материала и среды 1:9. По-
севы инкубируют 24-48 ч. при 37 гр.С.
Через 24 ч. и 48 ч. со второй среды обогащения (Мюллера, Кауфма-
на, магниевой, селенитового бульона) пересевают на две любые дифферен-
циальные среды (по выбору): Эндо, Плоскирева, Левина, висмут-сульфит-
ный агар.
Посевы просматривают через 18-24 ч. термостатирования при 37
гр.С. При отсутствии роста подозрительных колоний инкубирование посе-
вов продолжают еще 24 ч.
Сальмонеллы на средах Эндо и Плоскирева растут в виде прозрачных
бесцветных колоний, на среде Левина - бледно-розовых, голубоватых, ро-
зовато-фиолетовых колоний. На висмут-сульфитных агаре сальмонеллы рас-
тут в виде черных колоний с характерным металлическим блеском, при
этом наблюдается прокрашивание в черный цвет участка среды под колони-
ей. Исключение составляет S.paratyph,S.choleraesuis,S.abortus ovis,S.gal-
linarum-pullorum и некоторые другие, которые при росте на висмут-сульфи-
тном агаре образуют нежные светло-зеленые или серовато-зеленые колонии.
Из каждой среды на чашке Петри из подозрительных колоний (не ме-
нее трех) производят посев штрихом и уколом на одну из комбинированных
сред (Ольхеницкого, Клиглера, Ресселя).
Пробирки с посевами выдерживают в термостате при 37 гр.С. 24 ч.
Производят индентификацию культур, высеянных на комбинированные среды
по ферментации лактозы, глюкозы, сахарозы и расщеплению мочевины.
Покраснение или пожелтение скошенной части столбика среды Ольхеницкого
указывают на образование кислоты в результате форментации лактозы, са-
харозы или обоих сахаров. Покраснение или пожелтение самого столбика
указывают на расщепление глюкозы. Восстановление цвета среды до исход-
ного (бледно-розовый) свидетельствует с расщеплением мочевины.
Моханизм действия среды Клиглера и Ресселя идентичен со средой
Ольхеницкого. Об образовании сероводорода судят по почернению среды в
столбике.
Если культуры сбраживают лактозу с образованием газа и расщепляют
мочевину, они не принадлежат к бактериям рода сальмонелл.
Культуры, не ферментирующие лактозу и не расщепляющие мочевину,
но ферментирующие глюкозу (с образованием или без образования газа),
подвергаются дальнейшему исследованию.
Подозрительные колонии с комбинированной среды пересевают в про-
бирки со скошенным МПА, а также на среды Гисса с сахаром, 1%-ную пеп-
тонную воду для определения индола и сероводорода.
Сальмонеллы расщепляют маннит с образованием кислоты, вследствие
чего меняется цвет среды Гисса.
При исследовании на индол и сероводород из подозрительной колонии
микроорганизмы высевают в пробки с 1%-ной пептонной водой и термоста-
тируют при 37 гр.С., 24 ч. Затем в пробку с суточной культурой по
стопке добавляют 5-10 капель реактива Эрлиха. При наличии индола не позд-
нее, чем через 5 мин в пограничном слое образуется ярко-красное кольцо,
при отсутствии - кольца остается светло-желтого цвета.
Для определения индолобразования пользуется также реактивом Кова-
ча. К суточной культуре добавляют 0,2-0,3 куб.см. реактива и взбалты-
вают. Результаты учитывают через 10 мин.; реактив поднимается на по-
верхность среды и при наличии индола окрашивается в темно-красный цвет.
Сальмонеллы индола не обоазуют.
Для определения сортоводорода в пробирку с посевом культуры в
1%-ную пептонную воду помещают под пробку полоску фильтрованной бума-
ги, предварительно смоченной уксуснокислым свинцом и высушенную. По-
лоска не должна соприкасаться с питетнльной средой. Посев инкубирует
при 37 гр.С. 24-72 ч. Если культура выделяет сероводород, то бумажка с
уксусокислым свинцом чернеет от образующегося сернистого свинца.
При использовании среды Клиглера об образовании сероводорода су-
дят по почернению среды в столбике.
Сальмонеллы выделяют сероводород.
Из пробирок с комбинированной средой с суточной культурой, пока-
завшей типичную окраску среды для сальмонелл, или из пробирок с суточ-
ной культурой, пересеянной на МПА, проводят серологическое исследова-
ние. Для этого петлей берут небольшое количество культуры из пробирок,
эмульгируют в капле физиологического раствора на предметном стекле.
Добавляют каплю поливалентной О-сыворотки к раствору и осторожно пока-
чивают предметное стекло, чтобы смешать жидкости.
Положительная реакция на сальмонеллы (агглютимация) наблюдается в
течение 30-60 сек. Обязательна постановка отрицательной реакции (куль-
тура + физиологический раствор). Если при проведении серологического
исследования агглютинации не обнаруживается, конечный результат запи-
сывают как отсутствие сальмонелл.
Любая агглютимация, которая появляется на стекле, говорит о веро-
ятности присутствия сальмонелл.
По показаниям для полной биохимической типизации сальмонелл про-
водят посев на расширенный пестрый ряд (ГОСТ 7702.2-74) и реакция агг-
лютимации не только с 0, по Н-сыворотками (ГОСТ 7702.2-74).
![]()
![]()